2019儿童肿瘤年度进展盘点
中山大学肿瘤防治中心 儿童肿瘤科 路素英
2020年已悄然来到,肿瘤治疗马不停蹄,新药、新方案不断更新结果、不断取得突破,ASCO和SIOP会议硕果累累。今天就来汇总2019年小儿肿瘤诊治的重磅跃进事件,一起见证取得重大进展的成果。由于儿童肿瘤种类众多,这次主要分享一些常见疾病的进展。
儿童肿瘤基因突变检测结果令人备受鼓舞
儿童实体瘤总体突变频率较低,最高仅约15%,大部分在2~5%。而今年的ASCO报道了COG开展的一项MATCH试验,该实验中使用涵盖针对多种肿瘤靶向药物的52个基因的Oncomine肿瘤基因试剂盒进行测序,以检测基因突变、扩增和融合,旨在于复发/难治性儿童肿瘤患者中鉴定出与当前10种靶向治疗相匹配的基因变异。这些基因变异主要包括NTRK、FGFR、EZH2和SWI/SNF复合基因、PI3K/MTOR信号通路、MAPK信号通路、ALK或ROS1、BRAF、DNA损伤修复缺陷、细胞周期基因、MAPK信号通路等。该研究的中期分析显示,422例中,24%的患者可检测出与已有靶向药物匹配的基因突变,这项研究结果令人鼓舞。目前国内针对儿童肿瘤NGS的panel尚属空白,我们寄希望于基因检测公司和单位能积极开发适用于儿童肿瘤的基因检测试剂盒,这样更有助于提高儿童肿瘤基因变异的检出率,更好地指导患者的治疗。
Larotrectinib和恩曲替尼给儿童肿瘤患者带来靶向治疗的曙光
2018年11月27日,美国FDA批准首个TRK抑制剂Larotrectinib用于治疗NTRK基因融合的晚期实体瘤患者。Larotrectinib在治疗Trk基因融合的成人和儿童多种类型的实体瘤的临床试验中,总体缓解率(ORR)达75%,而且该药物有效时间持久,中位有效持续时间约为12个月。Larotrectinib是一个“异病同治”道路上具有里程碑意义的药物,是可以跨病种、跨年龄使用的靶向药。总体上仅有约1%的肿瘤患者有NTRK 基因融合。儿童中,Trk 融合基因的概率在婴儿纤维肉瘤和先天性中胚层肾瘤中约为75%,在软组织肉瘤和原发性中枢神经系统肿瘤中约为25%。

2019年8月19日,美国FDA批准Entrectinib(中文名暂定恩曲替尼)上市,用于NTRK阳性实体瘤或ROS1阳性肺癌患者,有效率为57%和77%,脑转移患者疗效尤佳。也就是说,任何癌症患者,只要有NTRK基因融合,不管是肺癌、乳腺癌还是肠癌,都可以考虑使用,不限癌症类型,只看“基因特征”。
恩曲替尼的靶点包含NTRK1/2/3、ROS1 和ALK 基因,它可以通过血脑屏障,并且没有不良的脱靶活性。今年ASCO和SIOP大会均公布了一项针对儿科和青少年患者的I/Ib期STARTRK-NG研究结果,该数据同样成为恩曲替尼获批上市的重要参考证据。该研究显示出显著、快速、持久、令人惊叹的疗效。研究纳入了29例年龄为4.9个月~20岁的复发或难治性实体瘤(包括颅内肿瘤)患者,这些患者携带NTRK1/2/3、ROS1或ALK基因融合。结果显示,在12例效果可评估的患者中,ORR达到了惊人的100%。尤其重要的是有效时间持久,中位有效时间持续10.51个月。其中,6例颅外实体瘤患者(3例炎性肌纤维母细胞瘤、2例婴儿纤维肉瘤、1例黑素瘤)中,有1例(DCTN1-ALK融合)完全缓解(CR),5例(TFG1-ROS1,EML4-NTRK3,KIF5B-ALK,ETV6-NTRK3融合)部分缓解(PR)。5例颅内肿瘤患者中有1例(ETV6-NTRK3融合)CR,4例(TPR-NTRK1,EEF1G-ROS1,EML1-NTRK2,GOPC-ROS1融合)PR。值得关注的是,神经母细胞瘤中有6%~10%的散发性NB带有体细胞 ALK 突变,还有3%~4%具有高频率 ALK 基因扩增,在此研究中,1例ALK F1174L 突变的神经母细胞瘤患者获得CR,这意味着神经母细胞瘤携带ALK 突变的患者可尝试恩曲替尼。
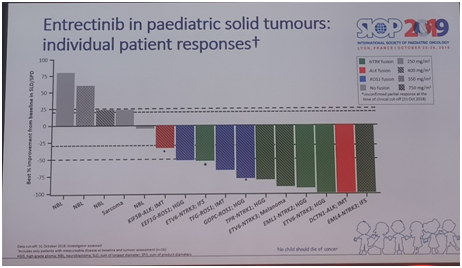
Larotrectinib和恩曲替尼代表了一种新的癌症治疗理念——“异病同治”,此疗法代表着精准治疗时代个性化治疗的进步,尽管儿童肿瘤患者总体突变频率较低,在靶向治疗领域进步较为缓慢,但这两个药物无疑给儿童肿瘤患者打开了一扇全新的希望之门。
神经母细胞瘤(NB)研究进展
2015年随着抗GD2单抗的上市,国外研究报道的高危神经母细胞瘤的生存大为改善,无事件生存可达50%以上,总生存率可达70%以上。欧洲的一项Ⅲ期临床试验的结果显示,联合使用IL-2并不会提高无事件生存率和总生存率,反而会增加过敏和毛细血管渗出等毒副作用,其研究结果发表于《柳叶刀·肿瘤》杂志。
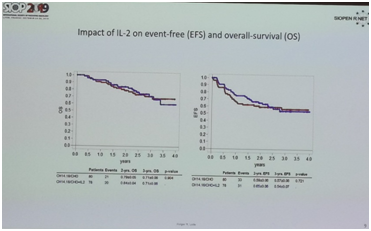
2019年ASCO大会上SIOPEN的一项随机临床研究早期结果显示,IL-2维持治疗并未使患者的生存获益,但是发热和疼痛等毒副作用增加。这项研究中建议抗GD2单抗维持治疗不推荐联合IL-2,2年EFS已经达到60%以上,2年OS达80%以上,因此建议作为高危神经母细胞瘤维持治疗的标准方案。
抗GD2单抗联合化疗在复发难治NB中的研究:SIOPEN LTI研究——长时间输注抗GD2单抗Dinutuximab beta(DB)联合或不联合皮下白介素-2(scIL-2)治疗复发和难治的高危神经母细胞瘤患者的随机临床试验在今年的ASCO报道,结果显示DB联合scIL-2组对比DB组,2年的EFS略有提高,客观缓解率也略有提高,但不可忽视的是,联合IL-2组显着提高了3~4级的毒性反应(发热、过敏反应、血液学毒性和神经毒性)。综合而言,scIL-2在联合DB治疗方面没有带来实际上的生存获益。
2019年SIOP也报道了一项II期临床研究,入组患者都是对先前治疗耐药的高危神母患者,包括先前使用过GD2单抗Dinutuximab治疗的患者,或使用过伊立替康/替莫唑胺这类化疗药物治疗的患者。结果显示,46例患者入组,无论是难治性还是耐药进展患者,都取得了疗效。该研究提示,大剂量Naxitamab为基础的免疫治疗+化疗的模式,在复发难治的神母治疗过程中安全有效,有望为广大患儿带来新的治疗选择。
目前,国内抗GD2 单抗已加入我国临床急需新药名单,有望在国内上市。
B7-H3抑制剂131I-Omburtamab于2017年6月7日获FDA突破性疗法认证,用于治疗复发难治伴有中枢神经系统或脑膜转移的儿童神经母细胞瘤,今年SIOP公布的数据来看,该药在中枢转移的神经母细胞瘤中表现不俗,108例有中枢转移的NB患者,中位OS 为3.7 年,2年 OS为57%,5年OS为41%,10年OS 为37%。131I-Omburtamab在中枢转移的NB患者中表现惊艳,值得期待!
横纹肌肉瘤(RMS)研究进展
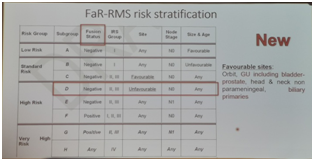
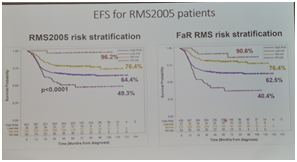
一直以来,欧洲的专家把横纹肌肉瘤患者依据“RMS2005分层法”分为4个风险组:低危、中危、高危和极高危。该分组的依据是6个指标:组织学类型、初次手术的结果、肿瘤的原发部位和大小、淋巴结受累程度和患者的年龄。这个分组到底是否有效?能否改进呢?在本次SIOP会议上,公布了一项新的研究结果,在该报告中,研究者一共分析了按风险分组的803名RMS患者。结果显示:第一,RMS2005分层法是有效的,因为它能有效预测4个风险组的预后。5年的无事件生存期分别为:低危96.2%,中危76.4%,高危64.4%,极高危49.3%。第二,用融合基因来取代组织学类型,似乎能更好地识别复发风险较高的患者。第三,原发肿瘤部位为膀胱/前列腺或肝胆管的RMS,预后都比较好,5年无事件生存期分别为 75.8%和76.5%。该研究提示我们RMS的危险度分层值得进一步探讨,有可能促使产生新的危险度分层方案。
肝母细胞瘤研究进展
肝母细胞瘤全球协作组(CHIC)的建立,融合了SIOP、COG 、JPLT、HB等多个协作组,建立了新的全球肝母细胞瘤危险分层以及依据该分层确立的治疗方案,这是全球协作的开始,期待该研究的新成果。
血液肿瘤研究进展
急性髓细胞性白血病
BCL2抑制剂Venetoclax在初诊或复发的急性髓细胞性白血病(AML)成人的治疗中已显示有效,然而在儿童AML的安全性和有效性尚不明确。今年ASCO口头报道一项将Venetoclax联合大剂量阿糖胞苷和伊达比星治疗儿童复发/难治性AML临床研究,结果显示Venetoclax在儿童患者耐受性好。Ⅱ期临床研究结果推荐Venetoclax与大剂量阿糖胞苷或大剂量阿糖胞苷/伊达比星联合使用时的合适剂量为360mg/m2 (最大剂量为600mg/m2)。研究初步显示Venetoclax在儿童复发/难治AML单药客观缓解率达66.7%,表现优异,而且该药能口服用药,生物利用度高,使用方便。Venetoclax联合大剂量阿糖胞苷和伊达比星,有望成为儿童复发/难治AML的标准挽救治疗方案。
儿童急性淋巴细胞白血病/淋巴瘤
Calaspargase是新型的半衰期更长的门冬酰胺酶,今年ASCO一项DFCI 11-001研究——比较培门冬酶(SS-PEG)和calaspargase pegol(SC-PEG)在儿童急性淋巴细胞白血病/淋巴瘤中的疗效和毒性,结果发现calaspargase pegol在给药后的3周,血清天冬酰胺酶活性高于培门冬酶,疗效相当且副作用无差异,这对于calaspargase pegol用于临床提供了依据。
以上便是儿童肿瘤2019年的一些亮点。总体而言,约有70%的儿童肿瘤患者可获得治愈。儿童肿瘤表观遗传学、转化医学研究以及免疫治疗依然是我们儿童肿瘤领域未来的方向和热点。最后,希望通过我们的努力和团结协作能使每一个儿童肿瘤患者都获得治愈。






